Wasserstoff
Physikalische Eigenschaften
Die Geschichte des Wasserstoffes
Wasserstoffgas wurde lange Zeit als Traggas in der Luftschifffahrt eingesetzt. Der tragische Unfall der Hindenburg ist nur ein Aspekt in der ambivalenten Geschichte des Wasserstoffgases und seines Einsatzes bei Zeppelinen. Bereits die Geschichte der Entdeckung von Wasserstoff hält einige interessante Fakten bereit. Was ist Wasserstoff eigentlich? Wie wurde es entdeckt? Wie wird Wasserstoff hergestellt? Warum wurde es trotz seiner Unsicherheit trotzdem bei Zeppelinen eingesetzt? All dies können sie auf den folgenden Seiten nachlesen.
Physikalische Eigenschaften
Wasserstoff ist vom Aussehen her ein farb-, geruch- und geschmackloses Gas, es befindet sich im Periodensystem unter der Ordnungszahl 1.
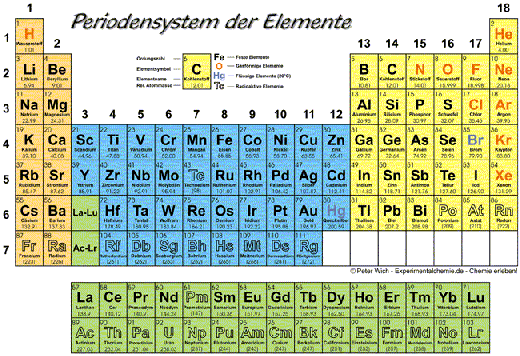
Die Atommasse von Wasserstoff beträgt 1,0079, seine Siedepunkt liegt bei -252,8 Grad Celsius, sein Schmelzpunkt bei -259,14 Grad Celsius. Als wichtigste und zugleich vorteilhafteste Eigenschaft für die Luftschifffahrt ist jedoch die geringe Dichte von 0,0988 Kilogramm pro Kubikmeter zu nennen, aus welcher eine hohe Tragkraft resultiert. Wasserstoff ist leicht entzündlich, worin auch sein größter Nachteil für die Verwendung als Traggas liegt und welcher viele Unfälle verursachte.
Wasserstoff findet sich in freiem Zustand kaum, dagegen ist er in zahlreichen anorganischen (hauptsächlich im Wasser) und fast allen organischen Verbindungen vertreten.Die Geschichte des Wasserstoffes
Die Erwähnung des Wasserstoffs durch mehrere Naturforscher reicht bis ins 15. Jahrhundert zurück. Dem Engländer Robert Boyle gelang 1671 dessen Umsetzung mit Eisen und Schwefel- bzw. Salzsäure. Es ist jedoch Henry Cavendish, der gemeinhin als Entdecker des Wasserstoffs gilt, da er 1766 als erster diese "brennbare Luft" nicht mit der gewöhnlichen Luft gleich setzte, sondern ein davon verschiedenes Gas vermutete. In seinem Experiment untersuchte er die Einwirkung verschiedener Säuren auf unterschiedliche Metalle.Dabei identifizierte er ein bislang unbekanntes Gas . Als strikter Anhänger der damals vorherrschenden Phlogistontheorie erkannte er in diesem Gas fälschlicherweise das reinste Phlogiston, das frei von Masse in allen Metallen enthalten sei und bei Verbrennung daraus entweiche. Später modifizierte er seine Theorie dahingehend, dass er im Wasserstoffgas nicht mehr das reine Phlogiston, sondern eine Art Phlogistonverbindung mit Wasser sah. Vom Modell des Phlogistons wich er jedoch nie ab, obwohl ihm Lavoisiers Arbeiten über die Oxidation der Stoffe bekannt waren und er selbst dazu maßgeblich beigetragen hatte.
Antoine Lavoisier forschte im Zuge seines Angriffes auf die Phlogistontheorie mit dem Wasserstoff, den er als "Hydrogenium", wovon sich sein heute gebräuchlicher Name ableitet, bezeichnete. Am 24.06.1783 führte er mit Hilfe eines geeigneten Verbrennungsapparates einen Versuch durch, in welchem er zeigen konnte, dass das Verbrennungsprodukt reines Wasser ist und somit der Satz von der Erhaltung der Masse zutrifft. Dieses Experiment gelang vor ihm wohl schon Cavendish und Watt, die aber keinen Widerspruch zur Phlogistontheorie darin sahen. Im Zuge der kostengünstigen Herstellung des Wasserstoffs für zum Beispiel Ballonfahrten, wie die von Jacques Alexandre César Charles, konnte Lavoisier das Wasser in seine Bestandteile Sauerstoff und Wasserstoff zerlegen. Bereits die Brüder Montgolfier wollten in ihrem Ballon Wasserstoff verwenden, scheiterten allerdings an dem zu schnellen Diffundieren des Gases durch die Oberfläche des Ballons.
Erst Charles gelang es das Gas im Ballon zu halten und damit 1783 seine ersten erfolgreichen Flüge zu unternehmen, was ihm nur wenige Monate später als den Brüder Montgolfier mit ihrem Heißluftballon geglückt war. Somit war Charles quasi der Pionier der Luftfahrt mit Wasserstoff, wie dies später die Luftschiffbau Zeppelin GmbH u.a. Unternehmen im großen Maßstab betrieben.
Robert Boyle

Henry Cavendish

Antoine Lavoisier
